 |
 |
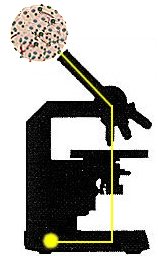
microscopio normale |
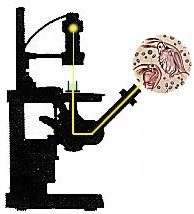
microscopio invertito |
GiÓ nella prima metÓ del 21░ sec. vengono sviluppati
strumenti e metodi che si diffonderanno poi nella seconda metÓ del secolo, permettendo di
migliorare le possibilitÓ di studio dei microrganismi acquatici. Tra i pi¨
importanti sono da citare:
- il microscopio invertito
- le membrane filtranti
- il microscopio con dispositivi per visione in fluorescenza
- il microscopio elettronico
- gli isotopi radioattivi da usare come traccianti e contatori in grado di misurali
- gli strumenti automatizzati per la microanalisi elementare
Il microscopio invertito
Nel microscopio normale l'obbiettivo Ŕ messo in modo da stare sopra il preparato, che Ŕ costituito da un vetrino portaoggetto sul quale viene collocato l'oggetto da esaminare. Questa disposizione limita, nel caso di un campione liquido, a poche gocce la quantitÓ dell'oggetto da osservare. Disponendo l'obbiettivo sotto al preparato come avviene nel microscopio invertito, Ŕ possibile usare invece del vetrino portaoggetto una celletta col fondo trasparente, che pu˛ contenere diversi millilitri di campione liquido. Cosý gli organismi sospesi in un campione di acqua di lago per sedimentazione si concentreranno sul fondo della celletta e sarÓ possibile esaminarne un numero sufficiente per contarli e misurarli..
 |
 |
microscopio normale |
microscopio invertito |
| Un campione di plancton concentrato in una celletta di sedimentazione ed
esaminato al microscopio invertito appare cosý ==> La scala visibile sullo sfondo Ŕ 1 mm, suddiviso in 10 intervalli di 100 Ám e 20 di 50 Ám. E' evidente che accanto a crostacei, rotiferi * ed alghe * ben riconoscibili, ci sono molti oggetti * che per le loro dimensioni non risultano identificabili. Le limitazioni intrinseche del microscopio invertito ne impediscono l'uso per l'esame di organismi del plancton pi¨ piccoli di 5 Ám |
 |
Le membrane filtranti
Il problema di concentrare organismi planctonici di piccole dimensioni, attorno ad 1Ám circa, ha iniziato a trovare una soluzione quando sono divenute disponibili delle membrane filtranti con pori tali da trattenere particelle di dimensioni inferiori al micron.
| Le membrane filtranti in esteri di cellulosa furono le prime a comparire sul mercato verso la fine degli anni '50. La loro porositÓ minima Ŕ di 0.45 Ám. Come si pu˛ vedere dalla microfotografia qui di lato, fatta al microscopio elettronico a scansione, esse hanno una struttura spugnosa. Se si filtra un campione d'acqua attraverso questo tipo di membrane alcune cellule possono infiltrarsi nella matrice spugnosa e non sono piu visibili quando il filtro Ŕ osservato al microscopio. |  |
| Negli anni '70 hanno fatto la comparsa i filtri in policarbonato con porositÓ minima di 0.2 Ám. Il miglioramento introdotto da questi filtri Ŕ evidente dall'esame della microfotografia qui a lato: i pori hanno margini ben definiti e presentano dimensioni abbastanza costanti. Queste caratteristiche ed il modesto spessore dei filtri riducono il problema della scomparsa delle particelle nella matrice della membrana. |  |
| Agli inizi degli anni '90 sono apparsi i filtri in ossido di alluminio. La porositÓ minima Ŕ scesa a 0.01 Ám, ma esistono anche con porositÓ 0.2 Ám. Come si vede assomigliano ancora di pi¨ ad un setaccio ideale, avendo il massimo numero di pori per unitÓ di superficie. |  |
Osservando al microscopio i filtri sui quali Ŕ stato concentrato quanto Ŕ sospeso in un campione d'acqua Ŕ per˛ difficile riconoscere i microrganismi dalle minuscole particelle di detrito e le particolaritÓ morfologiche non sono sempre tali da aiutare nella distinzione tra organismi e detrito. Un passo notevole in questa direzione Ŕ stato fatto con l'introduzione del microscopio ad epifluorescenza e con l'uso dei coloranti fluorescenti specifici per gli acidi nucleici e che, quindi, colorano selettivamente gli organismi differenziandoli dal detrito.
Il microscopio ad epifluorescenza
I popolamenti di batteri acquatici sono di solito costituiti da un insieme eterogeneo di organismi tassonomicamente diversi, molto piccoli e con una morfologia molto semplice, incolori. Al microscopio ottico non sono, quindi, facilmente distinguibili dalle particelle di detrito anche usando le tecniche di colorazione convenzionali della microbiologia. Il problema di differenziare in modo sicuro i batteri dal detrito Ŕ stato risolto con l'introduzione della microscopia in epifluorescenza e dei coloranti fluorescenti selettivi per gli acidi nucleici.
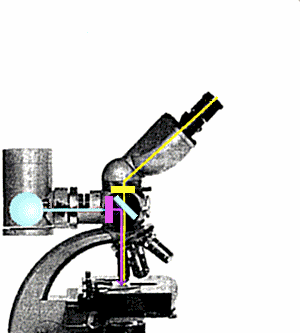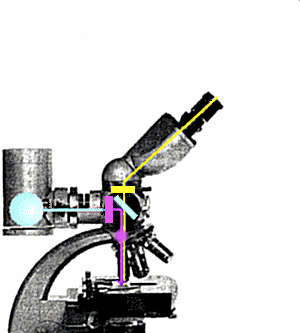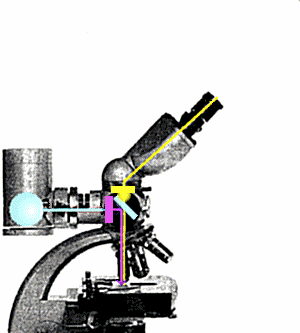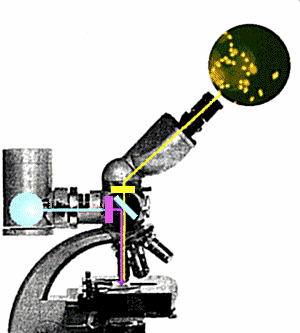 |
Nel microscopio convenzionale la luce arriva al preparato da sotto, lo
attraversa e, passando attraverso le lenti, genera l'immagine dell'oggetto. Nel
microscopio ad epifluorescenza il preparato Ŕ illuminato da sopra da un fascio di luce
che, deviato da un apposito specchio dicroico, attaversa l'obbiettivo. Un filtro
interposto tra la sorgente di luce ed il sistema ottico provvede a selezionare la
lunghezza d'onda opportuna (ultravioletto) per eccitare la fluorescenza del preparato.
Questa Ŕ di lunghezza d'onda superiore a quella della luce di eccitazione; attraversa lo
specchio dicroico senza esserne deviata e pu˛ raggiungere l'oculare per generare
l'immagine. Un filtro di barriera blocca l'ultravioletto residuo prima dell'oculare
impedendogli di raggiungere l'occhio dell'osservatore.
|
La fluorescenza del preparato pu˛ essere generata da una colorazione con i coloranti specifici per gli acidi nucleici (per esempio Arancio di Acridina o DAPI) oppure pu˛ essere generata da sostanze fluorescenti naturalmente presenti nelle cellule dei microrganismi autotrofi. I microrganismi capaci di fotosintesi hanno dei pigmenti, come per esempio la clorofilla, che sono fluorescenti se eccitati con una luce di lunghezza d'onda opportuna.
E' cosý possibile anche la distinzione tra microrganismi eterotrofi (batteri saprofiti), fluorescenti soltanto dopo una opportuna colorazione, ed autotrofi (cianobatteri), autofluorescenti per la presenza di pigmenti fotosintetici.
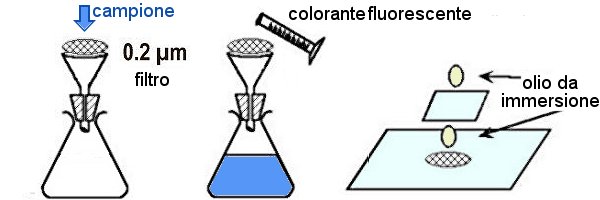
La preparazione dei campioni per l'esame in epifluorescenza avviene in tre fasi: 1) concentrazione degli organismi sul filtro; 2) colorazione con fluorocromi (questa operazione Ŕ ovviamente omessa se si esaminano gli organismi autofluorescenti); 3) montaggio del preparato per l'esame al microscopio
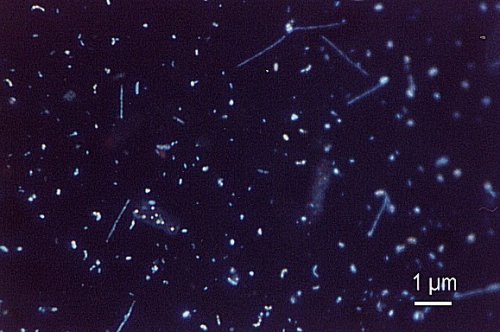
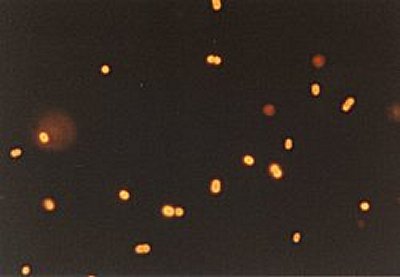
Ed ecco una microfotografia di batteri colorati con DAPI:
una microfotografia di batteri colorati con arancio di acridina:

| Negli anni 50 si diffonde un potente strumento per l'analisi delle strutture cellulari: il Microscopio Elettronico a Trasmissione (TEM), ideato da Manfred von Ardenne ed Ernst Ruska ed apparso nel 1931. Il TEM sfrutta la disomogeneitÓ di trasparenza agli elettroni dei materiali biologici opportunamente trattati per produrne immagini ingrandite. Con il TEM diviene possibile studiare in dettaglio anche le strutture interne delle cellule. |  |
|
Successivamente diviene disponibile il Microscopio Elettronico a Scansione (SEM) che, a differenza del TEM, consente di studiare la superficie degli oggetti e degli organismi. Esso trova, quindi, largo impiego anche nello studio della morfologia dei microrganismi acquatici. Qui a lato c'Ŕ la sezione schematica di un SEM, utile per illustrarne il funzionamento. Il campione da osservare, disidratato e reso conduttivo, Ŕ posto in una camera all'interno della quale viene fatto il vuoto. Un fascio di elettroni primari, opportunamente focalizzato da lenti elettroniche, viene inviato sul campione muovendolo, con un sistema generatore di scansione, cosý da farlo scorrere sulla superficie dell'oggetto in esame. Il fascio di elettroni durante la scansione del campione colpisce la sua superficie generando degli elettroni secondari. La quantitÓ e l'energia degli elettroni secondari retrodiffusi da ogni punto del campione colpito dal fascio elettronico dipendente dalla morfologia, oltre che dalla natura chimica, del campione in quel punto. Un rivelatore di elettroni secondari retrodiffusi provvede a raccogliere il segnale generato da ogni punto del campione durante la sua scansione con il fascio di elettroni primari. Un sistema di generazione dell'immagine acquisisce il segnale fornito dal rivelatore durante la scansione del campione e lo invia su uno schermo, ove viene cosý tracciata l'immagine del campione esaminato. |
Il microscopio a scansione non Ŕ, per il suo costo e la difficoltÓ di utilizzo, alla portata di tutti. Esistono per˛ dei microscopi a scansione virtuali che possono dare un'idea della visione al SEM. Uno lo potete vedere cliccando qui; altri ai siti:
Ed ecco come appaiono, visti al SEM, i rapporti dimensionali tra gli organismi che costituiscono il plancton:
 |
|
macroplancton >200 Ám (crostaceo Bosmina)
|
|
micropancton 20-200 Ám (alga coloniale Asterionella) |
|
nanoplancton 2-20 Ám |
|
picoplancton 0.2-2 Ám (batteri) |